Lesezeit: 11 Minuten
Daten der Versorgungsforschung in der Onkologie geben neben den Zulassungsstudien einen wichtigen und realen Input für die Behandlung der Patienten*innen in der täglichen Praxis. Mittlerweile hat sich die Immuntherapie in den meisten Tumorentitäten etabliert, sowohl als Monotherapie als auch in Kombination mit anderer Substanzen wie Targeted- und Chemotherapeutika. Gerade in der Uro-Onkologie hat sich das Behandlungsspektrum in den letzten Jahren deutlich erweitert und nahezu auf jedem internationalen Kongress werden neue Substanzen und Kombinationen präsentiert.
Auf dem Satellitensymposium der DGFIT auf dem Urologischen Winterworkshop 2025 in Leogang wurden neben verschiedenen Aspekten der Versorgungsforschung auch neue Daten der Uro-Onkologie vorgestellt. Das Symposium wurde von Prof. Dr. Michael Siebels (München) und Prof. Dr. Elfriede Nössner (München) moderiert.
Nachsorge in der Uro-Onkologie: Verpflichtung und Abrechnung am Beispiel des Nierenzellkarzinoms
Prof. Dr. med. Christian Doehn, Urologikum Lübeck, Lübeck

Hintergrund
Jährlich erkranken mehr als 14.000 Menschen in Deutschland an einem Nierenzellkarzinom (www.rki.de). Die Mehrzahl der Tumoren wird heutzutage zufällig im Rahmen von bildgebenden Untersuchungen erkannt.
Nach der operativen Primärtherapie stellt sich wie bei allen Tumorerkrankungen die Frage der möglichst effizienten Nachsorge. Allerdings ist die Nachsorge des Nierenzellkarzinoms bislang nicht standardisiert.
Nachfolgend werden verschiedene Aspekte der Nachsorge (Ziele, Leitlinienempfehlungen, Effektivität und Abrechnung) beim nichtmetastasierten Nierenzellkarzinom diskutiert.
Ziele einer Nachsorge
Die Nachsorge des nichtmetastasierten Nierenzellkarzinoms nach erfolgter Therapie sollte nach der S3-Leitlinie Nierenzellkarzinom vor allem folgende Ziele verfolgen:
- therapiebedingte Komplikationen erkennen
- die Nierenfunktion kontrollieren
- ein Lokalrezidiv nach organerhaltender Therapie erkennen
- ein Tumorwachstum oder Progress anderer Art unter aktiver Überwachung erkennen
- einen kontralateralen Nierentumor erkennen
- Fernmetastasen erkennen
Best of leitliniengerechte Nachsorge
Nachfolgend sind vier Leitlinien zum Nierenzellkarzinom in der jeweils aktuellen Fassung (S3-Leitlinie Deutschland (Stand 2024); nccn-Leitlinie USA (Stand 2025); EAU-Leitlinie Europa (Stand 2024) und AUA-Leitlinie USA (Stand 2021)). Es werden jeweils drei Risikogruppen definiert, die allerdings unterschiedlich definiert sind (Tabellen 1-3). Dargestellt ist die jeweilige Häufigkeit einer Schnittbildgebung von Thorax und Abdomen in einem Zeitraum von 5 Jahren.
Tabelle 1: Nachsorge bei geringem Risiko
| Leitlinie | Definition | Innerhalb von 5 Jahren | |
| Thorax | Abdomen | ||
| S3-LL | T1 G1/2 | 3x | 3x |
| NCCN | T1 | 5x | 5x |
| EAU | Leibovich-Score 2-4 | 4x | 4x |
| AUA | T1 G1/2 | 4x | 4x |
Tabelle 2: Nachsorge bei intermediärem Risiko
| Leitlinie | Definition | Innerhalb von 5 Jahren | |
| Thorax | Abdomen | ||
| S3-LL | T1 G3/4, T2 G1/2, R1, ablative Therapie | 6x | 4x |
| NCCN | T2 | 5x | 7x |
| EAU | Leibovich-Score 3-5 | 6x | 6x |
| AUA | T1 G3/4, T2 | 6x | 6x |
Tabelle 3: Nachsorge bei hohem/sehr hohem Risiko
| Leitlinie | Definition | Innerhalb von 5 Jahren | |
| Thorax | Abdomen | ||
| S3-LL | T2 G3/4, T3, T4, N+ | 7x | 5x |
| NCCN | T3, N1 | 8-14x | 8-14x |
| EAU | Leibovich 6+ | 8x | 8x |
| AUA high | T3 | 8x | 8x |
| AUA very high | T4, N1, sarkomatoid, R2 | 10x | 10x |
Best of leitliniengerechte Nachsorge
In der sog. RECUR-Studie von Dabestani et al. wurden 1.612 Patienten (12 Institutionen/8 Länder) mit einem Nierenzellkarzinom eingeschlossen (Dabestani et al., Eur. Urol. 2019).
Bei 336 Patienten (21%) wurde ein Rezidiv nachgewiesen. Die Autoren stellten sich die Frage, inwieweit ein Abweichen von der Nachsorge wie sie in der EAU-Leitlinie empfohlen wird (bis 74% der empfohlenen Bildgebung, 75-199% der empfohlenen Bildgebung vs. ab 200% der empfohlenen Bildgebung) einen Einfluß auf das Überleben nach Rezidivdiagnose besitzt. Es zeigten sich tatsächlich keine Unterschiede zwischen den drei Gruppen. Außerdem wurde kalkuliert, dass für die Detektion eines Rezidivs 52 CTs/MRTs, für die Detektion eines potentiell heilbaren Rezidivs 188 CTs/MRTs und für die Detektion eines tatsächlich geheilten Rezidivs 542 CTs/MRTs notwendig sein würden.
Abrechnung
Die Nachsorge des nichtmetastasierten Nierenzellkarzinoms ist im GKV-System klar, knapp und kostengünstig geregelt. In dem Quartal, in dem eine aktive Therapie (z.B. OP, Radiatio, Systemtherapie) erfolgt, kann die Onkologieziffer 86512 (Genehmigung vorausgesetzt) in Ansatz gebracht werden (z.B. Schleswig-Holstein Stand 1/2025: 24,69 €). Streng genommen handelt es sich eher um eine Betreuungsziffer als eine Nachsorgeziffer. Für die eigentliche Nachsorge sieht der EBM für insgesamt 4 Quartale den jeweiligen Ansatz der Ziffer 26315 (z.B. Schleswig-Holstein Stand 1/2025: 23,67 €) vor. Damit ist jeglicher Nachsorgeaufwand „abgegolten“.
Fazit zur Nachsorge
- Die Nachsorge des nichtmetastasierten Nierenzellkarzinoms ist nicht standardisiert.
- In den ersten 3 Jahren nach Primärtherapie sollte eine intensivere Nachsorge erfolgen.
- Patienten mit höherem Rezidivrisiko sollten in der Nachsorge häufiger und länger untersucht werden.
- Anamnese, klinische Untersuchung und Laboruntersuchungen sind notwendig, für das Auffinden von Metastasen jedoch von untergeordneter Bedeutung.
- Bildgebende Verfahren sind der Goldstandard zur Detektion von Metastasen:
- Lungenmetastasen: CT besser als MRT . (Röntgen Thorax übersieht kleine Metastasen und sollte daher nicht vorgenommen werden)
- Knochenmetastasen: CT oder MRT (Knochenszintigraphie nur bei klinischem Verdacht)
- Lebermetastasen: MRT besser als CT
- Lymphknotenmetastasen: CT besser als MRT
- Der Patient sollte Zugang zu einer psychoonkologischen Betreuung haben
- Der Patient sollte die Patientenleitlinien Nierenzellkarzinom ausgehändigt bekommen
Immuntherapie 2.0 – von BiTEs bis zur Brezel
PD Dr. Jozefina Casuscelli, Urologische Klinik und Poliklinik LMU Klinikum der Universität

Die Immuntherapie hat sich stark weiterentwickelt und eröffnet neue Behandlungsansätze. Beim Prostatakarzinom bleibt die Immuntherapie aufgrund des „kalten“ Tumor-Phänotyps eine Herausforderung. Aktive Immuntherapien wie Sipuleucel-T zeigen einen gewissen Überlebensvorteil, sind aber nicht überall verfügbar. Checkpoint-Inhibitoren wirken nur bei bestimmten Subgruppen, weshalb eine gezielte Patientenauswahl entscheidend ist. BiTE- und TriTE-Therapien zeigen erste Wirksamkeit, allerdings mit hohen Nebenwirkungen. Kombinationsstrategien könnten hier zukünftig eine Rolle spielen.
Beim Urothelkarzinom als „heißem“ Tumor sind die Erfolge der Immuntherapie deutlich größer. BCG bleibt eine etablierte Therapie, doch es gibt Bestrebungen zur Optimierung oder Ersetzung. Antikörper-Wirkstoff-Konjugate und Checkpoint-Inhibitoren zeigen vielversprechende Ergebnisse im metastasierten Stadium. Neue Applikationsmethoden wie TAR-200 („Brezel“) ermöglichen eine gezielte lokale Medikamentenfreisetzung. Studien sollen helfen, radikale Eingriffe zu vermeiden und die Lebensqualität der Patienten zu verbessern.
DGFIT nachgefragt: Aktuelle Therapie des nicht muskel-invasiven Urothelkarzinoms der Harnblase (NMIBC)
Prof. Dr. A. Hegele, Marburg
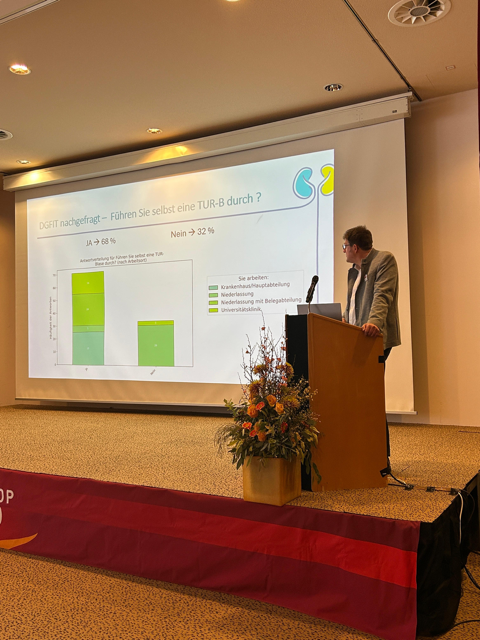
Für die Diagnostik und Therapie sowie Rezidivprophylaxe des NMIBC existieren vielfältige Möglichkeiten. Ziel der aktuellen Umfrage der Deutschen Gesellschaft für Immun- und Targeted-Therapie (DGFIT) war es die Behandlungsrealität des NMIBC in Deutschland zu erfassen. Hierzu wurde ein Fragebogen bestehend aus 26 Fragen via E-Mail, online und QR-Code verteilt. Abgefragt wurde neben der Art der Diagnostik (starre/flexible Zystoskopie/ Einsatz von urinbasierten Markern) auch ob und wann PDD und eine Frühinstillation eingesetzt werden. Ebenso ob eine Langzeitinstillationsprophylaxe durchgeführt wird, mit welcher Substanz (Chemo oder BCG) in welcher NMIBC Risikogruppe sowie der Zeitpunkt einer Zystektomie. Insgesamt nahmen 103 Ärzteinnen an der Umfrage teil, 78% waren männlich und 57% arbeiten in einer urologischen Praxis, davon 24% mit einer urologischen Belegabteilung. 43% arbeiten in einer urologischen Hauptabteilung, davon 19% an einer Universitätsklinik. Die Mehrzahl der Teilnehmerinnen (75%) ist über 40 Jahre und es handelt sich bei 94% um erfahrene Urologen*innen (Chefarzt/Oberarzt/Facharzt).
Erfreulicherweise hat die Zystoskopie mit einem starren Instrument keine Stellenwert mehr und flexible Instrumente kommen überwiegend zum Einsatz im Rahmen der Primärdiagnostik und Kontrolle. Urinbasierte Marker spielen „real world“ in Deutschland aktuell keine Rolle. 68% führen selbst eine TUR-B durch – zu nahezu gleichem Anteil durch Niedergelassene und Hauptabteilungen. 74% setzen bei der TUR-B regelmässig PDD ein, jedoch ist der Zeitpunkt (immer, nur beim Erstbefund, im Rezidiv, nur bei high-risk) unklar. Eine Frühinstillation mit einem Chemotherapeutikum wird – obwohl nicht im DRG-System finanziell abgebildet – von 89% durchgeführt. Hier kommt vor allem Mitomycin zur Anwendung (89%, davon 62% Mitomycin 40 mg). Eine entsprechend den Leitlinien empfohlene Langzeitinstillationsprophylaxe ab intermediärem Risiko wird von 66% „immer“ und 26% „meistens“ durchgeführt. Primär wird vor allem Mitomycin (84%) und nur selten BCG (12%) instilliert. Sollte es hierunter zu einem Rezidiv kommen erfolgt in den meisten Fällen die BCG-Therapie. Beim Erstbefund eines Hoch-Risiko NMIBC erfolgt in 92% der Fälle eine BCG-Therapie, die Zystektomie wird vor allem nach Versagen der BCG Therapie empfohlen. Aufgrund der innovativen und neuen Behandlungsoptionen sowohl mit Substanzen (IO, FGFR) als auch Applikationsarten (intravesikaler „drug-eluting stent“ „Brezel“), welche aktuell in Studien evaluiert werden (z.B. Sunrise-Trial, Thor-Trial, Potomac-Trial), schätzen 58% der Befragten einen Blasenerhalt auch im Falle des BCG-Versagens in der Zukunft als realistisch ein (10% antworteten mit „nein“ und 32% mit „weiß nicht“).
Fazit:
Die Behandlung des NMIBC in Deutschland erfolgt sowohl in den urologischen Praxen als auch Hauptabteilungen. Die PDD-Technik im Rahmen der TUR-B wird ebenso wie die Frühinstillation mit Mitomycin in der Mehrzahll der Fälle durchgeführt. Eine risiko-gruppenadaptiere Langzeitinstillationsprophylaxe erfolgt ebenso: im intermediären Risiko vor allem mit Mitomycin, im Rezidiv (intermediär) oder bei high-risk NMIBC kommt vor allem BCG zum Einsatz. Die Zystektomie wird vor allem nach Versagen der BCG-Therapie (high risk) empfohlen. Ein möglicher Blasenerhalt nach BCG-Versagen durch neue Substanzen und Applikationsmethoden wird von der Mehrzahl der Behandler in der Zukunft als realistisch eingeschätzt.
Rational design of PD-1-CD28 immunostimulatory fusion proteins for CAR T cell therapy
Dr. med. Theo Lorenzini, Klinik und Poliklinik für Nuklearmedizin Klinikum der Technischen Universität München

Den Abschluss des Symposiums bildete der Vortrag des CSA-Preisträgers 2024 mit anschließender Preisverleihung. Die DGFIT unterstützt seit ihrer Gründung wissenschaftliche Forschungsprojekte auf dem Gebiet der Immun- und Targeted Therapie. Unter anderem wird jährlich der mit 2.000,00 Euro dotierte Clinical Science Award vergeben. Mit dem CSA 2024 wurde Dr. Theo Lorenzini (München) ausgezeichnet für seine Arbeit „Rational design of PD-1-CD28 immunostimulatory fusion proteins for CAR T cell therapy“.
Das Projekt widmet sich der Weiterentwicklung der CAR-T-Zelltherapie, einer revolutionären Form der Krebsimmuntherapie. Bei dieser innovativen Methode werden T-Zellen, eine zentrale Komponente des Immunsystems, genetisch so verändert, dass sie Tumorzellen gezielt erkennen und bekämpfen. Dazu wird den T-Zellen ein sogenannter chimärer Antigenrezeptor (CAR) hinzugefügt, der es ihnen ermöglicht, spezifische Oberflächenstrukturen von Krebszellen zu identifizieren. Während die CAR-T-Zelltherapie besonders bei Blutkrebs beeindruckende Erfolge erzielt hat, wird ihre Wirksamkeit häufig durch die immununterdrückende Tumorumgebung begrenzt. Ein wesentlicher Mechanismus dieser Einschränkung ist der PD-1-Signalweg, der die Erschöpfung der T-Zellen fördert und ihre Funktion hemmt.
Zur Überwindung dieses Problems wurden in diesem Projekt innovative immunstimulierende Fusionsproteine (IFPs) entwickelt und untersucht: diese wandeln nämlich die inhibitorischen PD-1-Signale in aktivierende Signale um. Ziel ist es, die Funktion der CAR-T-Zellen gezielt im Tumorgewebe zu verstärken, ohne dabei systemische Nebenwirkungen zu verursachen oder gesundes Gewebe zu schädigen.
Im Rahmen der Studie wurden mögliche IFP-Designs systematisch in vitro und in vivo analysiert, die sich durch Unterschiede in der Länge und Struktur ihrer verschiedenen Domänen auszeichneten.
Die Ergebnisse zeigten, dass IFPs mit physiologischer Länge die Aktivität der CAR-T-Zellen signifikant verbesserten. Sie förderten eine stärkere Zellproliferation, eine erhöhte Zytokinproduktion und eine optimierte Abtötung von Tumorzellen, ohne dabei unspezifische Immunreaktionen auszulösen. Im Gegensatz dazu führten verlängerte IFPs zu unerwünschten CAR-unabhängigen Aktivierungen der T-Zellen.
In präklinischen Mausmodellen erwiesen sich physiologisch lange IFPs als besonders effektiv: Sie verbesserten die Tumorkontrolle signifikant und verlängerten das Überleben der Tiere. Verlängerte Varianten hingegen führten zu erhöhter Toxizität und schweren Nebenwirkungen.
Diese Ergebnisse unterstreichen die Bedeutung eines präzisen Designs der IFP-Struktur, um sowohl die Sicherheit als auch die Wirksamkeit der Therapie zu maximieren. Die Studie liefert wertvolle Erkenntnisse für die Weiterentwicklung der CAR-T-Zelltherapie und legt eine solide Grundlage für die Entwicklung neuer, sicherer und effektiver Ansätze zur Überwindung immununterdrückender Signalwege.
Verleihung des Clinical Science Award 2024 an Dr. Theo Lorenzini, München
v.l.n.r. Prof Dr. Axel Hegele (Vorstand DGFIT), Dr. Theo Lorenzini (CSA-Preisträger), Prof. Dr. Michael Siebels (Vorstand DGFIT), Prof. Dr. Elfriede Nößner (Vorstand DGFIT), Prof. Dr. Christian Doehn









